Healthcare Content Data Portal gewinnt GS1 Healthcare Award 2022
EKGs haben sich für GS1 GDSN entschieden, um Datenqualität zu verbessern und Prozesse zu digitalisieren
Branchenlösung auf Basis von BAYARDs cloud-basierter Plattform BYRD beflügelt elektronische Einkaufs- und Logistik-Prozesse durch Standardisierung und hohe Produktdatenqualität im Gesundheitswesen – Jury zeichnet kooperativen Ansatz mit dem GS1 Healthcare Award 2022 aus.
Unsere Success Stories
EKGs haben sich für GS1 GDSN entschieden, um Datenqualität zu verbessern und Prozesse zu digitalisieren
Die vier größten Einkaufsgemeinschaften (EKGs) des Gesundheitswesens in Deutschland, EKK plus, P.E.G., Prospitalia und Sana Einkauf & Logistik, haben sich zusammengeschlossen, um eine Plattform für den Datenaustausch zu etablieren. Nur zwei Jahre nach dem Start wurden bereits mehr als eine Million Produkte auf dieser Plattform publiziert.
Ein Jahr später sprechen die Ergebnisse für sich selbst:
- 30% mehr gelistete Produkte
- 35% Steigerung der Qualitätsziele für Produkte und Dienstleistungen, die den ECLASS-Standards entsprechen müssen
- 65% Steigerung der Qualitätsziele im Einkauf
- 560% Steigerung der Qualitätsziele in der Logistik
Unsere Success Stories
EKGs haben sich für GS1 GDSN entschieden, um Datenqualität zu verbessern und Prozesse zu digitalisieren
Die vier größten Einkaufsgemeinschaften (EKGs) des Gesundheitswesens in Deutschland, EKK plus, P.E.G., Prospitalia und Sana Einkauf & Logistik, haben sich zusammengeschlossen, um eine Plattform für den Datenaustausch zu etablieren. Nur zwei Jahre nach dem Start wurden bereits mehr als eine Million Produkte auf dieser Plattform publiziert.
Ein Jahr später sprechen die Ergebnisse für sich selbst:
- 30% mehr gelistete Produkte
- 35% Steigerung der Qualitätsziele für Produkte und Dienstleistungen, die den ECLASS-Standards entsprechen müssen
- 65% Steigerung der Qualitätsziele im Einkauf
- 560% Steigerung der Qualitätsziele in der Logistik
Viele Herausforderungen
Qualitätssicherung Ihrer Produktdaten
Gemäß COVIN – das Content Validation Network
COVIN hat das Ziel, die Qualität der von den Medizintechnikunternehmen bereitgestellten Produktstammdaten signifikant und nachhaltig zu steigern. Zukünftig sollen die Hersteller vorab prüfen können, ob ihre Daten den definierten Anforderungsstandard erfüllen. Das dafür notwendige Regelwerk COVIN ist veröffentlicht und in einer Tabelle zusammengefasst.
Das COVIN-Netzwerk ist ein gemeinsames Projekt der AGKAMED GmbH, clinicpartner eG, EK-UNICO GmbH, P.E.G. eG, GDEKK, Prospitalia GmbH sowie der Sana Klinik Einkauf GmbH.
#keineANGSTvorCOVIN
Bereitstellung Ihrer Produktdaten
Im HCDP – das Healthcare Content Portal
HCDP ist der neue Datenpool der Einkaufsgemeinschaften P.E.G. eG, Prospitalia GmbH sowie der Sana Klinik Einkauf GmbH.
Er bildet die Grundlage sicherer elektronischer Prozesse in Einkauf und Logistik in den Gesundheitseinrichtungen, wie eProcurement bzw. der zukünftigen elektronischen Rechnung. Über HCDP versorgen Hersteller und Lieferanten die angeschlossenen Gesundheitseinrichtungen kontinuierlich und einheitlich mit validierten Daten über einen standardisierten Prozess.
Registrieren Ihrer Produktdaten
UDI Daten für Europa und USA
Die Medical Device Regulation MDR verpflichtet die Hersteller von Medizinprodukten, die Daten über sich und über ihre Produkte für Europa in der EUDAMED zu speichern. Medizingeräte, die in den USA angeboten werden, müssen vorher in der Produktdatenbank (GUDID) der FDA elektronisch registriert sein.
Auch wenn die EU-Kommission am 30.10.2019 mitgeteilt hat, dass der Betrieb der EUDAMED Datenbank erst im Mai 2025 aufgenommen wird, sollten Sie das Thema nicht auf die lange Bank schieben. Um validierte Produktinformationen elektronisch zu registrieren ist mehr notwendig, als deren technische Bereitstellung. Hier bedarf es eigene Prozesse, Organisation und Systeme zu etablieren, welche die Aktualität und Qualität der Daten nachhaltig sicherstellen.
Lieferung Ihrer Produktdaten
Qualitätsgesichert an die NHS –Trusts
Zur Verbesserung der Supply Chain Kette, verlangt die NHS England, der größte Käufer von Medizinprodukten in Großbritannien, dass Produktdaten von Geräten elektronisch über das Global Data Synchronization Network (GDSN) bereitgestellt werden. Dies ist zwar keine regulatorische Anforderung, aber es ist für jedes Geräteunternehmen, das seine Produkte in Großbritannien vermarktet, unerlässlich zu verstehen und zu beachten.
Anmelden Ihrer Produkte
Im Niederländischen Implantatregister
Um Implantate schnell und effizient zu verfolgen, ist es gesetzlich vorgeschrieben, dass die Produkte im niederländischen Implantatregister, (LIR) gemeldet sind.
Verteilen Ihrer Produktdaten
Über GS1 GDSN an Ihre Kunden
Ihre Kunden fordern zunehmend aktuelle, umfangreiche und valide Produktinformationen. Und Sie müssen Ihre Prozesse effizienter gestalten. Das GS1 GDSN ist der Weg, diese Daten in einem standardisierten und automatisierten Prozess an viele Ihrer nationalen und internationalen Kunden zu liefern.
Viele Herausforderungen
Qualitätssicherung Ihrer Produktdaten
Gemäß COVIN – das Content Validation Network
COVIN hat das Ziel, die Qualität der von den Medizintechnikunternehmen bereitgestellten Produktstammdaten signifikant und nachhaltig zu steigern. Zukünftig sollen die Hersteller vorab prüfen können, ob ihre Daten den definierten Anforderungsstandard erfüllen. Das dafür notwendige Regelwerk COVIN ist veröffentlicht und in einer Tabelle zusammengefasst.
Das COVIN-Netzwerk ist ein gemeinsames Projekt der AGKAMED GmbH, clinicpartner eG, EK-UNICO GmbH, P.E.G. eG, GDEKK, Prospitalia GmbH sowie der Sana Klinik Einkauf GmbH.
#keineANGSTvorCOVIN
Bereitstellung Ihrer Produktdaten
Im HCDP – das Healthcare Content Portal
HCDP ist der neue Datenpool der Einkaufsgemeinschaften P.E.G. eG, Prospitalia GmbH sowie der Sana Klinik Einkauf GmbH.
Er bildet die Grundlage sicherer elektronischer Prozesse in Einkauf und Logistik in den Gesundheitseinrichtungen, wie eProcurement bzw. der zukünftigen elektronischen Rechnung. Über HCDP versorgen Hersteller und Lieferanten die angeschlossenen Gesundheitseinrichtungen kontinuierlich und einheitlich mit validierten Daten über einen standardisierten Prozess.
Registrieren Ihrer Produktdaten
UDI Daten für Europa und USA
Die Medical Device Regulation MDR verpflichtet die Hersteller von Medizinprodukten, die Daten über sich und über ihre Produkte für Europa in der EUDAMED zu speichern. Medizingeräte, die in den USA angeboten werden, müssen vorher in der Produktdatenbank (GUDID) der FDA elektronisch registriert sein.
Auch wenn die EU-Kommission am 30.10.2019 mitgeteilt hat, dass der Betrieb der EUDAMED Datenbank erst im Mai 2025 aufgenommen wird, sollten Sie das Thema nicht auf die lange Bank schieben. Um validierte Produktinformationen elektronisch zu registrieren ist mehr notwendig, als deren technische Bereitstellung. Hier bedarf es eigene Prozesse, Organisation und Systeme zu etablieren, welche die Aktualität und Qualität der Daten nachhaltig sicherstellen.
Lieferung Ihrer Produktdaten
Qualitätsgesichert an die NHS –Trusts
Zur Verbesserung der Supply Chain Kette, verlangt die NHS England, der größte Käufer von Medizinprodukten in Großbritannien, dass Produktdaten von Geräten elektronisch über das Global Data Synchronization Network (GDSN) bereitgestellt werden. Dies ist zwar keine regulatorische Anforderung, aber es ist für jedes Geräteunternehmen, das seine Produkte in Großbritannien vermarktet, unerlässlich zu verstehen und zu beachten.
Anmelden Ihrer Produkte
Im Niederländischen Implantatregister
Um Implantate schnell und effizient zu verfolgen, ist es gesetzlich vorgeschrieben, dass die Produkte im niederländischen Implantatregister, (LIR) gemeldet sind.
Verteilen Ihrer Produktdaten
Über GS1 GDSN an Ihre Kunden
Ihre Kunden fordern zunehmend aktuelle, umfangreiche und valide Produktinformationen. Und Sie müssen Ihre Prozesse effizienter gestalten. Das GS1 GDSN ist der Weg, diese Daten in einem standardisierten und automatisierten Prozess an viele Ihrer nationalen und internationalen Kunden zu liefern.

Einfach und schnell!
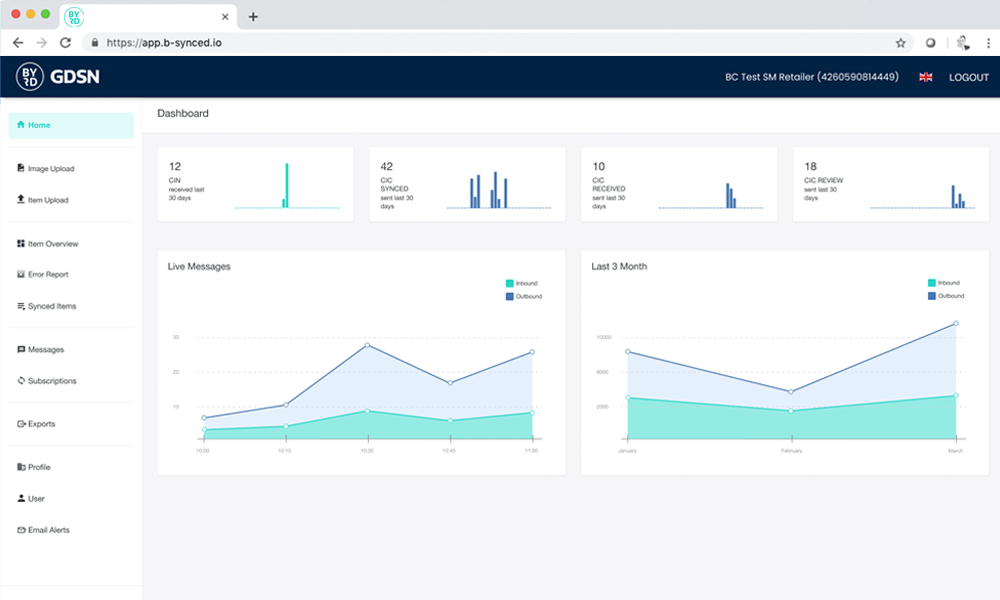
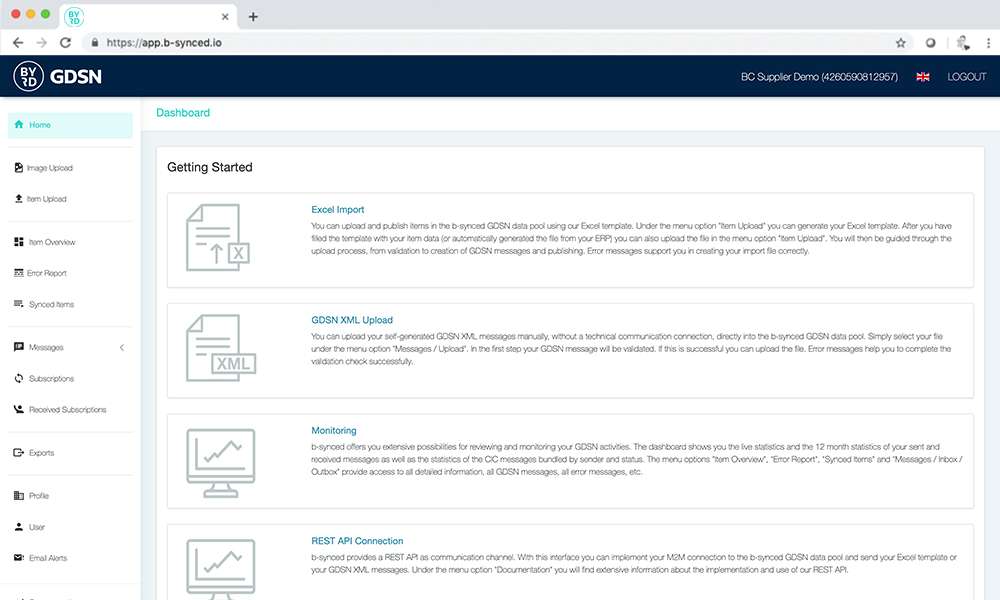
Der Excel-Upload von b-synced
b-synced bietet ein einfaches xlsx-Template, in dem Sie Ihre Produktdaten exportieren oder manuell erfassen können. Die ausgefüllte Datei laden Sie einfach über das Web-UI hoch und werden anschließend von b-synced durch den Validierungs- und Publikationsprozess geführt.
Einfacher geht es nicht! Und preiswerter auch nicht – der Excel-Upload ist Teil Ihres b-synced Abo-Preises.
Einfach und schnell!
Der Excel-Upload von b-synced
b-synced bietet ein einfaches xlsx-Template, in dem Sie Ihre Produktdaten exportieren oder manuell erfassen können. Die ausgefüllte Datei laden Sie einfach über das Web-UI hoch und werden anschließend von b-synced durch den Validierungs- und Publikationsprozess geführt.
Sollten Ihre Datenempfänger weitere Validierungen vornehmen und Ihnen das Ergebnis per CIC-Nachricht (CIC = Catalog Item Confirmation) mitteilen, so bietet Ihnen b-synced ein ausgefeiltes Reporting, über das Sie die Datenfehler einsehen und Ihre Daten korrigieren können.
Einfacher geht es nicht! Und preiswerter auch nicht – der Excel-Upload ist Teil Ihres b-synced Abo-Preises.
Schnell, flexibel und automatisiert!
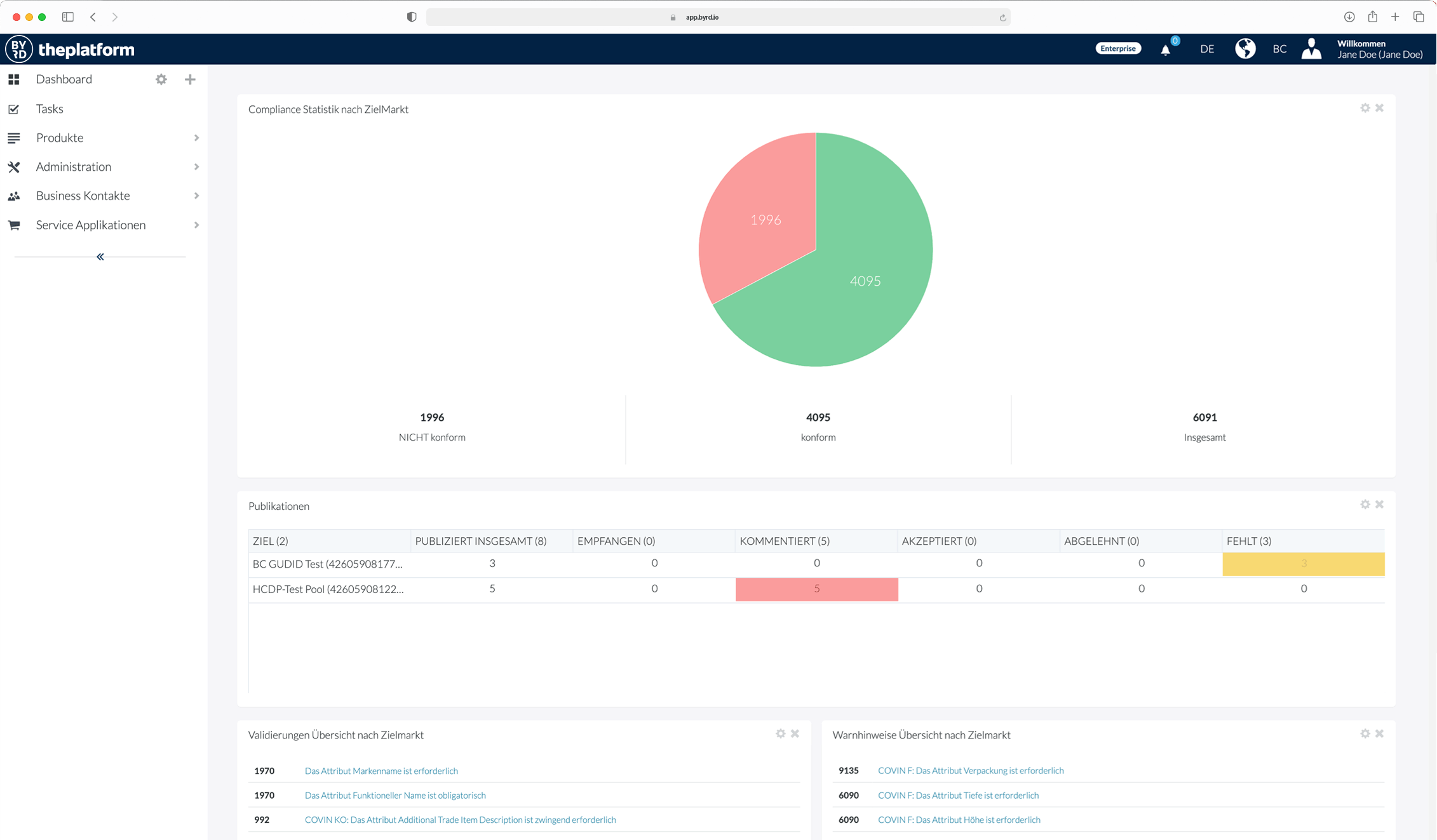
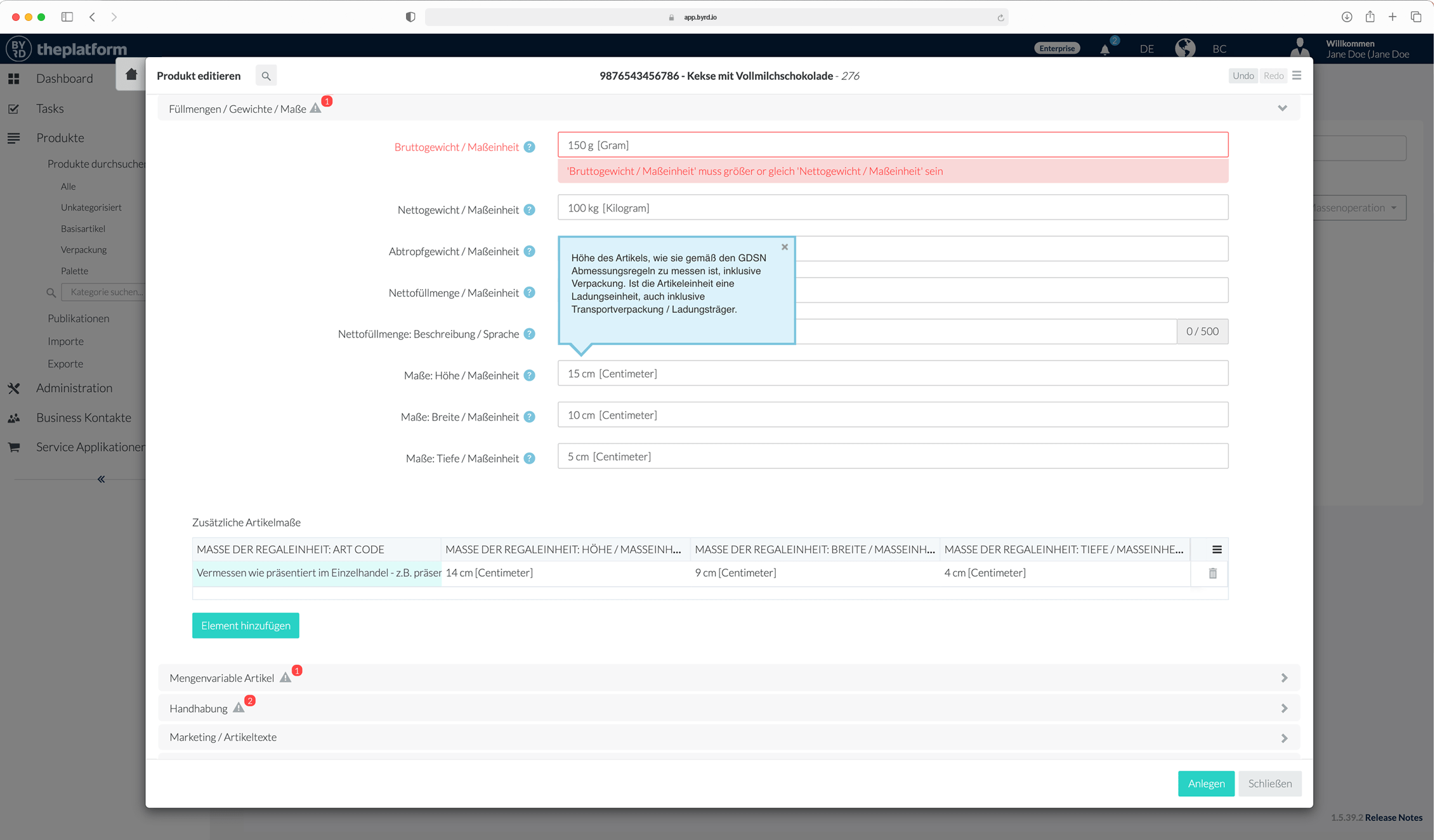
Nutzung der BYRD Content Syndication Plattform
Sie haben Ihre Daten bereits elektronisch in einem oder mehreren Systemen vorliegen und müssen eventuell nur noch einen Teil manuell ergänzen – dann ist unsere Cloud-PIM und -Syndication Plattform BYRD die Lösung.
Wir binden Ihre Systeme, die bereits Produktinformationen enthalten, an BYRD – theplatform an, richten Ihnen Anreicherungs- und Freigabe-Prozesse ein und schon sind Sie mit Ihren qualitätsgeprüften Produktinformationen live bei Ihren Kunden.
Schnell, flexibel und automatisiert!
Nutzung der BYRD Content Syndication Plattform
Sie haben Ihre Daten bereits elektronisch in einem oder mehreren Systemen vorliegen und müssen eventuell nur noch einen Teil manuell ergänzen – dann ist unsere Cloud-PIM und -Syndication Plattform BYRD die Lösung.
Wir binden Ihre Systeme, die bereits Produktinformationen enthalten, an BYRD – theplatform an, richten Ihnen Anreicherungs- und Freigabe-Prozesse ein und schon sind Sie mit Ihren qualitätsgeprüften Produktinformationen live bei Ihren Kunden.
Der Enterprise-Ansatz!
Implementierung von PIM als Geschäftsprozess
Sie wollen Product Information Management als Geschäftsprozess in Ihrem Unternehmen etablieren und setzen dabei auf die Einführung eines professionellen PIM-Systems?
Sprechen Sie mit uns!
Wir unterstützen Sie bei der Auswahl sowie der Implementierung eines professionellen PIM-Systems. Darüber hinaus sorgen wir für eine anschließende Anbindung an b-synced und der Datenbereitstellung über GDSN an Ihre Kunden.
Der Enterprise-Ansatz!
Implementierung von PIM als Geschäftsprozess
Sie wollen Product Information Management als Geschäftsprozess in Ihrem Unternehmen etablieren und setzen dabei auf die Einführung eines professionellen PIM-Systems?
Sprechen Sie mit uns! Wir unterstützen Sie bei der Auswahl sowie der Implementierung eines professionellen PIM-Systems. Darüber hinaus sorgen wir für eine anschließende Anbindung an b-synced und der Datenbereitstellung über GDSN an Ihre Kunden.
Auszug unserer Healthcare Kunden
GS1 GDSN liefert auf einfache und effiziente Weise qualitativ hochwertige Produktdaten – jetzt Video ansehen!


Verwalten Sie Gesundheitsdaten, sichern Sie deren Qualität und teilen Sie sie mit Ihren Geschäftspartnern.
Kontaktieren Sie uns und erfahren Sie mehr über die Vorteile der Verwaltung von Gesundheitsdaten für Ihren individuellen Geschäftsfall.